Traduction libre
20 déc. 2023
Dans le dernier article, j’ai examiné quelques techniques utilisées par les sociétés pharmaceutiques pour faire en sorte que leurs médicaments paraissent très bénéfiques. Tout d’abord, il s’agit de définir la maladie que vous essayez de traiter de telle sorte que tout ce que fait le médicament semble être une grande réussite. Le tour de magie. Le Prestige.
Une fois cela fait, vous développez impitoyablement le marché en veillant à ce que de plus en plus de personnes soient diagnostiquées avec la « maladie » que vous voulez que les médecins traitent. À ce stade, je vais humblement me citer dans mon livre « Doctoring Data (Truquer les données) ».
« En fait, une étude réalisée en Norvège il y a quelques années a examiné plus en détail la question des objectifs en matière de cholestérol et de tension artérielle. Sur la base des lignes directrices élaborées par la Société européenne de cardiologie (ESC), elle a établi qu’à l’âge de 50 ans, plus de 95 % des personnes auraient un taux de cholestérol ou une tension artérielle considérés comme suffisamment élevés pour nécessiter un traitement médicamenteux. Et ce, bien que les Norvégiens soient parmi les personnes les plus saines et les plus longues à vivre de la planète. Dieu sait donc ce qu’il en est pour le reste d’entre nous ».
Oui, quatre-vingt-quinze pour cent des personnes de plus de cinquante ans doivent prendre des médicaments pour le reste de leur vie. Vous plaisantez… non, désolé, vous êtes réellement sérieux.
Une autre technique très efficace consiste à s’assurer que des critères de substitution peuvent être utilisés pour revendiquer le succès. Qu’est-ce qu’un critère de substitution ?
Le mieux est peut-être de commencer par examiner les critères d’évaluation cliniques ? Dans un essai de médicament, un critère d’évaluation clinique consistera à démontrer quelque chose comme une réduction des crises cardiaques, des insuffisances rénales, de la douleur, de la dépression ou… de presque tous les désagréments auxquels vous pouvez penser. Infection fongique des ongles, calvitie masculine.
Il s’agit du type de choses que vous essayez d’empêcher de se produire, ou des conditions que vous essayez d’améliorer. À cette fin, vous mettez en place un essai contrôlé randomisé avec deux « bras », placebo contre médicament actif, et c’est parti. Ces essais peuvent durer plusieurs années et nécessiter des milliers de participants. Ils peuvent également coûter des millions, voire des centaines de millions de dollars.
Il convient toutefois de préciser que les essais n’ont pas besoin de durer aussi longtemps. Si, par exemple, vous essayez de prouver que votre médicament est efficace pour soulager la douleur. Il peut suffire de quelques heures, voire quelques minutes pour le démontrer.
Même dans ce cas, les choses ne sont pas aussi simples. Avant de chercher à prouver que votre médicament a un effet bénéfique, vous devez d’abord démontrer qu’il est sans danger. C’est-à-dire qu’il ne provoque pas d’insuffisance rénale, qu’il n’abîme pas le foie ou qu’il n’a pas d’autres effets tout aussi néfastes. Cela nécessite des études de sécurité et de toxicité. D’abord sur les animaux, puis sur les humains. Mais cela ne prend pas beaucoup de temps. Des semaines ou des mois, pas des années.
En revanche, si vous essayez de prouver que votre médicament réduit le risque d’insuffisance cardiaque, d’accident vasculaire cérébral ou de crise cardiaque, l’essai peut durer plusieurs années. En effet, il faut attendre longtemps avant qu’un événement clinique, tel qu’une crise cardiaque, ne se produise.
Et, à moins que, ou jusqu’à ce que, vous disposiez d’un nombre suffisant d’événements cliniques, ou de critères d’évaluation, vous ne pourrez pas revendiquer un « bénéfice statistiquement significatif ». Deux crises cardiaques contre une ne suffiront pas.
Cela signifie que les essais cliniques dans des domaines tels que la tension artérielle durent généralement cinq ans. Du moins, c’était le cas. Il en était de même pour les premiers essais sur la réduction du taux de cholestérol et du taux de sucre dans le sang. Cinq ans d’argent qui s’envolent, et aucun médicament à vendre.
Outre les coûts énormes liés à la conduite d’une étude de grande envergure, il y a un tic-tac d’horloge en arrière-plan. Les nouveaux médicaments bénéficient d’une protection par brevet d’une durée de vingt ans. Une fois ces vingt ans écoulés, le brevet expire. À ce moment-là, les fabricants de médicaments génériques peuvent légalement produire le même médicament et le vendre. Sans qu’il soit nécessaire de réaliser un seul essai clinique.
Ainsi, outre le coût énorme de l’essai lui-même, l’obligation d’attendre cinq ans, ou plus, avant de pouvoir mettre le médicament sur le marché représente une perte de revenus supplémentaire considérable. Cinq ans sur vingt.
La solution ?
Vous travaillez dur pour obtenir le consensus des experts selon lequel, par exemple, un taux de cholestérol élevé est réellement une cause de maladie cardiovasculaire. Ou, en d’autres termes, qu’il s’agit d’une véritable « maladie » nécessitant un traitement. Par conséquent, plus on réduit le taux de cholestérol, plus le bénéfice est important. Le même argument est utilisé pour réduire la tension artérielle et la glycémie.
Si vous parvenez à obtenir l’accord des autorités réglementaires, il n’est pas nécessaire de démontrer que votre médicament réduit les crises cardiaques et les accidents vasculaires cérébraux. Il vous suffit de montrer qu’il réduit le taux de cholestérol. Vous travaillez maintenant avec ce que l’on appelle un critère de substitution. [Il existe d’autres formes de critères de substitution.]
Dans ce contexte, il n’est pas difficile de comprendre pourquoi les sociétés pharmaceutiques sont plus qu’intéressées à ce que les critères de substitution soient acceptés comme critères de fin d’un essai clinique. Des milliards de dollars sont potentiellement en jeu.
Pour voir ce processus en action, nous pouvons remonter dans le temps, en commençant par un éditorial de l’American Heart Association Journal, intitulé The Cholesterol Controversy Is Over. Why Did It Take So Long? (La controverse sur le cholestérol est terminée. Pourquoi a-t-il fallu si longtemps ? 0
La controverse qui a entouré le problème du cholestérol et des maladies coronariennes pendant tant d’années a été, pour le moins, assez vive.
Aujourd’hui, la controverse est terminée. Le débat ne porte plus sur la question de savoir si l’hypercholestérolémie (L’hypercholestérolémie est le terme scientifique désignant l’augmentation du taux de cholestérol dans le sang) est un facteur causal, mais plutôt sur la meilleure façon de la traiter. En 1984, les National Institutes of Health ont organisé une conférence de consensus sur la réduction du cholestérol sanguin.
Le panel de la conférence, que j’ai eu le privilège de présider, « a conclu à l’unanimité qu’il existait une relation de cause à effet entre l’hypercholestérolémie et le risque de maladie coronarienne (MC) ».
Oui, il y a eu une conférence en 1984 qui a « conclu à l’unanimité qu’il existait une relation de cause à effet entre l’hypercholestérolémie et le risque de maladie coronarienne (MC) ».
La principale conclusion de la conférence, du point de vue des entreprises pharmaceutiques, est peut-être la suivante :
« Les personnes présentant un taux de cholestérol sanguin élevé doivent être traitées intensivement par des moyens diététiques sous la supervision d’un médecin, d’un diététicien ou d’un autre professionnel de la santé ; si la réponse au régime alimentaire est insuffisante, des médicaments appropriés doivent être ajoutés au traitement ».
Ils auraient dû dire : Quand le régime alimentaire ne fonctionne pas.
La conférence a été organisée peu de temps après que Merck a commencé les essais de sécurité et de toxicité, puis les premiers essais cliniques de la lovastatine, la première statine à être lancée sur le marché. Une coïncidence temporelle remarquable. Comme indiqué dans l’article « A historical perspective on the discovery of statins (Une perspective historique sur la découverte des statines) ».
« Le médicament a réduit de façon spectaculaire le taux de cholestérol et a été bien toléré. Aucune tumeur n’a été détectée. En novembre 1986, Merck a envoyé la demande de nouveau médicament (NDA) à la FDA américaine et la lovastatine a reçu l’approbation de la FDA pour devenir la première statine commerciale en septembre 1987 ».
Merck n’a jamais été tenue de prouver qu’il y avait une réduction des critères d’évaluation cliniques. Il suffisait de montrer que le médicament était sûr et qu’il réduisait le taux de cholestérol. Cela a suffi pour obtenir l’approbation de la FDA. En effet, le premier essai clinique sur la lovastatine a porté sur cinquante-neuf hommes et a duré quatre semaines.
A-t-on jamais démontré de manière irréfutable, en dehors des essais sur les médicaments, que le cholestérol est un facteur de risque pour les maladies cardiovasculaires ? Je vais vous montrer ci-dessous un tableau tiré de l’étude UK Biobank. Il s’agit probablement de la plus importante étude jamais réalisée sur les facteurs de risque d’un certain nombre de maladies, et pas seulement des maladies cardiovasculaires. Voici un extrait de leur site web :
« Qu’est-ce que la UK Biobank ?
La UK Biobank est une base de données biomédicales à grande échelle et une ressource de recherche contenant des informations dépersonnalisées sur la génétique, le mode de vie et la santé, ainsi que des échantillons biologiques provenant d’un demi-million de participants britanniques.
Il s’agit de l’ensemble de données le plus complet et le plus largement utilisé de sa catégorie, et il est accessible dans le monde entier aux chercheurs agréés qui entreprennent des recherches sur la santé dans l’intérêt du public, qu’ils soient issus du milieu universitaire, commercial, gouvernemental ou caritatif.
La UK Biobank contribue à faire progresser la médecine moderne et permet de mieux comprendre la prévention, le diagnostic et le traitement d’un large éventail de maladies graves et potentiellement mortelles — y compris le cancer, les maladies cardiaques et les accidents vasculaires cérébraux ».
Les responsables de l’étude Biobank ont analysé les facteurs de risque courants des maladies cardiovasculaires, tels que le tabagisme, le sexe, l’activité physique, la glycémie, etc. Ils ont produit de nombreux tableaux et graphiques.
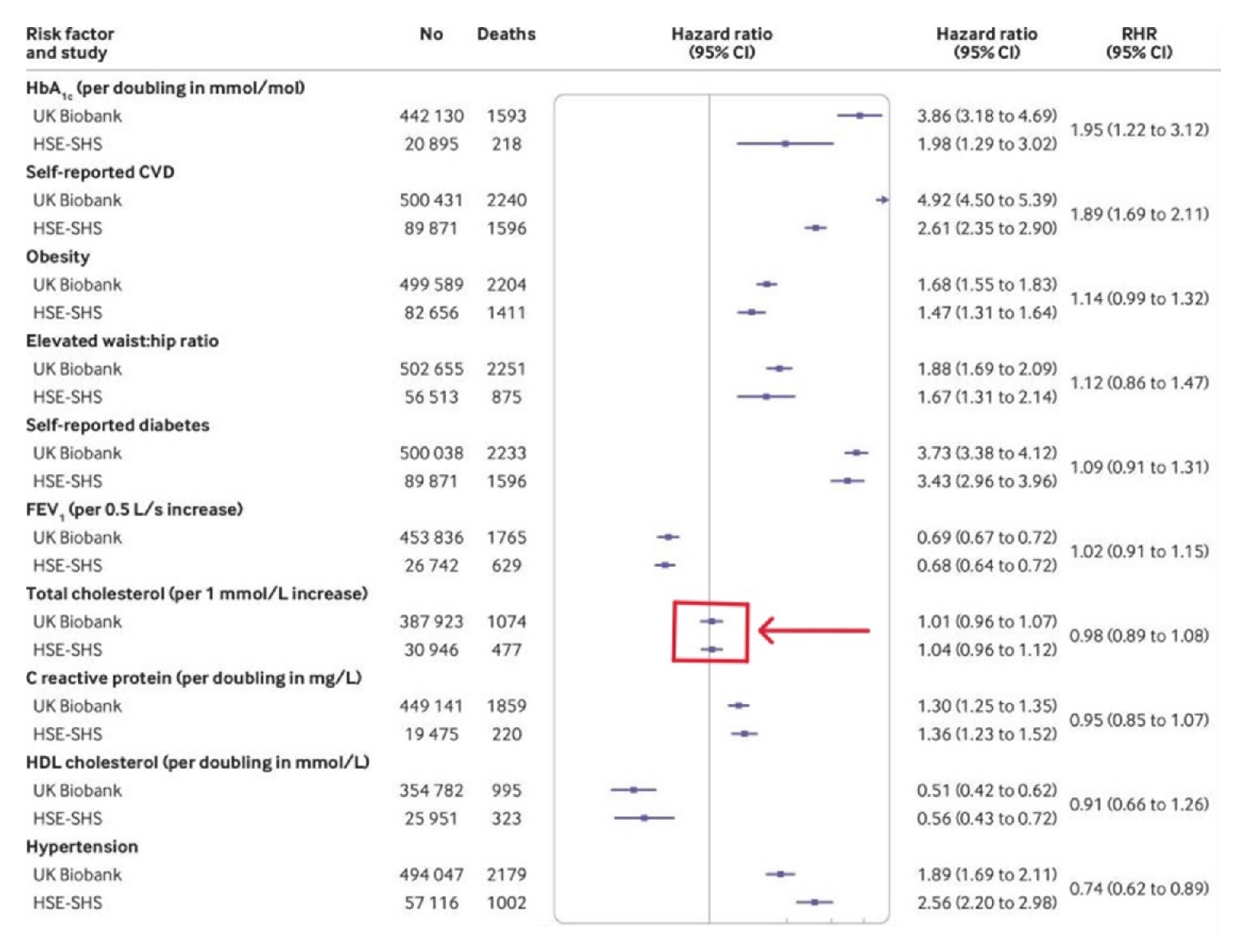
Le tableau ci-dessous est celui qui compare les taux de cholestérol au risque de mourir d’une maladie cardiovasculaire. Il établit le risque accru de MCV associé à chaque augmentation de 1 mmol/l du taux de cholestérol sanguin. [Les États-Unis et l’Europe utilisent des unités différentes pour mesurer le cholestérol. Aux États-Unis, l’unité utilisée est le mg/dl. 1 mmol/l = 38,67 mg/dl].
Tout d’abord, je voudrais attirer votre attention sur la ligne continue au milieu de la longue boîte rectangulaire. Cette ligne représente un « rapport de risque » de 1. Pour simplifier au maximum l’explication des rapports de risque, un rapport de risque de un (RR = 1) signifie un risque moyen de décès par maladie cardiovasculaire.
En d’autres termes, si votre RR est égal à un, vous n’êtes ni plus ni moins susceptible de mourir d’une maladie cardiovasculaire que la personne moyenne de votre âge, tous les autres facteurs de risque étant pris en compte. Si le rapport de risque (RR) est inférieur à un, le risque de décès cardiovasculaire est réduit. Si le rapport de risque est supérieur à un, le risque est accru.
Dans ce tableau, l’« intervalle de confiance » représente la fourchette de valeurs qui entoure le RR. Plus l’intervalle de confiance est étroit, plus la probabilité que votre résultat soit robuste est élevée (toutes nos excuses aux statisticiens qui liront ces lignes).
Expliquons. Si vous lancez deux fois une pièce de monnaie et que vous obtenez une fois pile et une fois face, votre « confiance » que cette pièce donnera pile ou face un nombre égal de fois est très « large ». Au fur et à mesure que vous lancez la pièce, l’intervalle de confiance se réduit. Après un million de lancers de pièces, avec un demi-million de pile et un demi-million de face, l’intervalle de confiance — qu’il y a une chance égale de tomber sur pile ou sur face — devient très, très étroit.
Poursuivons. En haut du tableau, vous pouvez voir qu’une glycémie élevée (mesurée par l’HbA1c) augmente considérablement le risque de maladie cardiovasculaire. Le rapport de risque est de 3,86. [Désolé, mais pour compliquer les choses, deux études différentes ont été utilisées dans cet article. Biobank et l’étude (ou les études) combinée(s) HSE-SHS, plus petite(s). Rien n’est jamais simple dans le monde des statistiques médicales. Mais les deux études sont à peu près d’accord sur tous les points. Comme l’étude HSE-SHS porte sur un plus petit nombre de personnes, les intervalles de confiance sont beaucoup plus larges. Une « barre » plus large].
Plus bas, j’ai mis en évidence le rapport des risques associés à chaque augmentation de 38,67 mg/dl (1 mmol/l) du taux de cholestérol sanguin, à l’aide d’une grosse flèche pointant vers une case.
Comme vous pouvez le constater, le RR pour une augmentation du cholestérol sanguin était si proche de un cela ne faisait aucune différence. En d’autres termes, un taux de cholestérol élevé n’est pas un facteur de risque de décès par maladie cardiovasculaire. En effet, il n’y a même pas le moindre indice d’un risque accru. (RR 0,98 IC = 0,89 — 1,08). De beaux intervalles de confiance serrés.
Extrait de « Comparaison des associations de facteurs de risque dans la UK Biobank avec des études représentatives de la population générale avec des taux de réponse conventionnels : étude de cohorte prospective et méta-analyse de participants individuels ».
Comparons et contrastons cela avec la conférence de 1984 qui « a conclu à l’unanimité qu’il existait une relation de cause à effet entre l’hypercholestérolémie et le risque de maladie coronarienne (MC) ».
[Les maladies coronariennes sont un sous-ensemble des maladies cardiovasculaires. Pour beaucoup, ces termes sont interchangeables].
Que dit ce document de la Biobank sur l’absence totale de lien entre le cholestérol et les maladies cardiovasculaires ?
-
Il s’agit de la première étude à comparer directement les associations de facteurs de risque dans la UK Biobank avec des études de cohortes représentatives au niveau national avec des taux de réponse conventionnels.
-
Les associations d’un large éventail de facteurs de risque avec les résultats de la mortalité ont montré une étroite concordance entre les études.
-
Les associations de facteurs de risque de la UK Biobank semblent pouvoir être généralisées.
La réponse à la question que j’ai posée ci-dessus est… rien.
Oui, vous pouvez trouver des études qui établissent un lien (faible) entre les maladies cardiovasculaires et le cholestérol. Vous pouvez également trouver le contraire, et toutes les conclusions intermédiaires. Je vais me citer à nouveau, en m’appuyant sur l’article « LDL-C does not cause cardiovascular disease: a comprehensive review of the current literature » (LDL-C ne cause pas de maladie cardiovasculaire : une revue complète de la littérature actuelle). [LDL-C = lipoprotéines de faible densité (cholestérol), la fraction du « cholestérol » dans le sang considérée comme « causale », c’est-à-dire le « mauvais » cholestérol.]
« L’idée qu’un taux élevé de cholestérol dans le sang est la cause principale des maladies cardiovasculaires est impossible, car les personnes ayant un faible taux de cholestérol deviennent tout aussi athéroscléreuses que les personnes ayant un taux élevé et leur risque de souffrir d’une maladie cardiovasculaire est le même, voire plus élevé. L’hypothèse du cholestérol a été maintenue en vie pendant des décennies par des commentateurs qui ont utilisé des statistiques trompeuses, exclu les résultats d’essais infructueux et ignoré de nombreuses observations contradictoires ».
J’ai été co-auteur de ce document.
Qu’ont dit récemment les « experts » sur l’utilisation du cholestérol LDL-C comme critère de substitution. Y a-t-il eu des changements ? Voici ce qui s’est passé en 2017 : « Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel ». (Les lipoprotéines de basse densité sont à l’origine des maladies cardiovasculaires athéroscléreuses. 1. Preuves issues d’études génétiques, épidémiologiques et cliniques. Une déclaration de consensus du groupe de consensus de la Société européenne d’athérosclérose).
Ils disent qu’il y a… :
« …. une association dose-dépendante et log-linéaire remarquablement cohérente entre l’ampleur absolue de l’exposition du système vasculaire au LDL-C et le risque d’ASCVD (= Maladie cardiovasculaire athérosclérotique) ; et cet effet semble augmenter avec la durée de l’exposition au LDL-C. Les études génétiques naturellement randomisées et les essais d’intervention randomisés démontrent de manière cohérente que tout mécanisme de réduction de la concentration plasmatique des particules de LDL devrait réduire le risque d’événements ASCVD proportionnellement à la réduction absolue du LDL-C et à la durée cumulée de l’exposition à un LDL-C plus faible, à condition que la réduction obtenue du LDL-C soit concordante avec la réduction du nombre de particules de LDL et qu’il n’y ait pas d’effets délétères concurrents hors cible ».
Au contraire, ils ont doublé la mise ces dernières années.
À ce stade, je pense qu’il est utile d’attirer votre attention sur la déclaration de conflit d’intérêts qui accompagne ce document. Un conflit d’intérêts signifie qu’un expert a travaillé avec une ou plusieurs entreprises pharmaceutiques et a reçu de l’argent de leur part. Dans le cas présent, dans le domaine thérapeutique de la réduction du cholestérol. Je ne m’attends pas à ce que vous lisiez tout.
« Conflit d’intérêts : J.B. a reçu des subventions de recherche d’Amgen, AstraZeneca, NovoNordisk, Pfizer et Regeneron/Sanofi et des honoraires pour des consultations et des conférences d’Amgen, AstraZeneca, Eli Lilly, Merck, Novo-Nordisk, Pfizer et Regeneron/Sanofi. E.B. a reçu des honoraires d’AstraZeneca, Amgen, Genfit, MSD, Sanofi-Regeneron, Unilever, Danone, Aegerion, Chiesi, Rottapharm, Lilly et des subventions de recherche d’Amgen, Danone et Aegerion. A.L.C. a reçu des subventions de recherche d’Amgen, Astra-Zeneca, Merck, Regeneron/Sanofi et Sigma Tau, ainsi que des honoraires pour des conseils consultatifs, des services de conseil ou de conférencier d’Abbot, Aegerion, Amgen, AstraZeneca, Eli Lilly, Genzyme, Merck/MSD, Mylan, Pfizer, Rottapharm et Sanofi-Regeneron. M.J.C. a reçu des subventions de recherche de MSD, Kowa, Pfizer et Randox et des honoraires pour des activités de consultant/conférencier d’Amgen, Kowa, Merck, Sanofi, Servier, Unilever et Regeneron. S.F. a fait les déclarations suivantes au cours des 12 derniers mois : Consultant rémunéré et activités de conseil avec Merck, Kowa, Sanofi, Amgen, Amarin et Aegerion. B.A.F. a reçu des subventions de recherche de Merck, Amgen et Esperion Therapeutics et a reçu des honoraires pour des conférences, des activités de conseil et/ou de membre de conseils consultatifs de Merck, Amgen, Esperion, Ionis et de l’American College of Cardiology. I.G. a reçu des honoraires de MSD et de Pfizer pour des conférences sur l’estimation du risque cardiovasculaire et les directives sur les lipides, ainsi que des honoraires de consultant/conférencier de la part d’Amgen. H.N.G. a reçu des subventions de recherche de Merck, Sanofi-Regeneron et Amgen. Il est consultant pour Merck, Sanofi, Regeneron, Lilly, Kowa, Resverlogix, Boehringer Ingelheim. R.A.H. a reçu des subventions de recherche d’Aegerion, d’Amgen, de The Medicines Company, de Pfizer et de Sanofi. Il est consultant pour Amgen, Aegerion, Boston Heart Diagnostics, Gemphire, Lilly et Sanofi. J.D.H fait état d’honoraires et de subventions de recherche de la part d’Aegerion, Alnylam, Catabasis, Lilly, Merck, Pfizer, Novartis, Regeneron et Sanofi. R.M.K. est membre de Merck Global Atherosclerosis Advisory Board. U.L. a reçu des honoraires pour des conférences et/ou des conseils de la part d’Amgen, Medicines Company, Astra Zeneca, MSD, Berlin Chemie, Bayer, Abbott et Sanofi. U. L. aufs a reçu des honoraires d’Amgen, MSD, Sanofi et Servier en tant que membre du conseil d’administration, consultant et conférencier. L.M. a reçu des honoraires d’Amgen, de Danone, de Kowa, de Merck et de Sanofi-Regeneron pour des services de conseil et des conférences. S.J.N. a reçu une aide à la recherche de la part d’Amgen, AstraZeneca, Anthera, Cerenis, Novartis, Eli Lilly, Esperion, Resverlogix, Sanofi-Regeneron, InfraReDx et LipoScience et est consultant pour Amgen, AstraZeneca, Boehringer Ingelheim, CSL Behring, Eli Lilly, Merck, Takeda, Pfizer, Roche, Sanofi-Regeneron, Kowa et Novartis. B.G.N. fait état de consultations et d’honoraires pour des conférences données par AstraZeneca, Sanofi, Regeneron, Aegerion, Fresenius, B Braun, Kaneka et Amgen. C.J.P. a reçu une aide à la recherche de Roche et de MSD, ainsi que des honoraires de MSD, Sanofi/Regeneron, Amgen et Pfizer. F.J.R. a reçu des subventions/un soutien à la recherche de la part d’Amgen et de Sanofi et a reçu des honoraires de conférencier ou des honoraires de consultation de la part d’AstraZeneca, de Merck, d’Amgen et de Sanofi. K.K.R. a reçu des subventions de recherche d’Amgen, de Sanofi-Regeneron et de Pfizer, ainsi que des honoraires pour des conférences, des conseils consultatifs ou en tant que membre du comité directeur d’Aegerion, d’Amgen, de Sanofi-Regeneron, de Pfizer, d’AstraZeneca, de Cerenis, d’ISIS Pharma, de Medco, de Resverlogix, de Kowa, de Novartis, de Cipla, de Lilly, d’Algorithm, de Takeda, de Boehringer Ingelheim, de MSD. Esperion et AbbieVie. H.S. a reçu des subventions de recherche d’AstraZeneca, MSD, Bayer Vital, Sanofi-Aventis et Pfizer, ainsi que des honoraires de conférencier d’AstraZeneca, MSD, Genzyme, Sanofi-Aventis et Synlab. Il a été consultant pour MSD et AstraZeneca. M.R.T. a reçu des honoraires de conférencier de la part d’Amgen, Astra Zeneca, Chiesi Pharma et Eli Lilly, ainsi que des honoraires de conférencier et un soutien à la recherche de la part d’Amgen, Sanofi-Aventis et Novo Nordisk. Elle a été consultante pour AstraZeneca. L.T. a reçu des fonds de recherche et/ou des honoraires pour des conseils consultatifs, des services de conseil ou d’orateur de la part d’Abbott Mylan, Actelion, Aegerion, Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Daiichi-Sankyo, GlaxoSmithKline, Menarini, Merck, Novartis, Pfizer, Sanofi-Regeneron, Servier et Synageva. G.F.W. a reçu une aide à la recherche de la part d’Amgen et de Sanofi-Regeneron. O.W. a reçu des honoraires de Sanofi, Amgen, MSD et Astra-Zeneca pour des conférences ou des services de conseil. B.v.S. et J.K.S. ne font état d’aucune divulgation.
Résumé
L’utilisation de critères de substitution pour les essais cliniques représente une augmentation considérable des bénéfices des sociétés pharmaceutiques. Celles-ci travaillent donc dur, en coulisses, pour s’assurer que cela se produise. Il s’agit d’un autre élément clé de la « mise en place » visant à faire passer les médicaments pour hautement bénéfiques. Vous, le public, et la quasi-totalité des médecins n’êtes pas conscients de ce qui se passe.
Références :
1. The cholesterol controversy is over. Why did it take so long? (La controverse sur le cholestérol est terminée. Pourquoi cela a-t-il pris si longtemps ?); Daniel Steinberg, MD, PhD ; Circulation, Volume 80, Issue 4, October 1989.
2. Lowering Blood Cholesterol to Prevent Heart Disease (Réduire le taux de cholestérol sanguin pour prévenir les maladies cardiaques); JAMA Network, avril 1985.
3. A historical perspective on the discovery of statins (Une perspective historique sur la découverte des statines); National Library of Medicine; mai 2010.
4. Cholesterol-lowering effect of mevinolin, an inhibitor of 3-hydroxy-3-methylglutaryl-coenzyme a reductase, in healthy volunteers (Effet hypocholestérolémiant de la mévinoline, un inhibiteur de la 3-hydroxy-3-méthylglutaryl-coenzyme a réductase, chez des volontaires sains); JA Tobert et al ; National Library of Medicine; avril 1982.
5. What is UK Biobank? (Qu’est-ce que la UK Biobank ?)
6. Comparison of risk factor associations in UK Biobank against representative, general population based studies with conventional response rates: prospective cohort study and individual participant meta-analysis (Comparaison des associations de facteurs de risque dans la UK Biobank avec des études représentatives de la population générale avec des taux de réponse conventionnels : étude de cohorte prospective et méta-analyse de participants individuels); G David Batty et. al ; The BMJ; February 2020.
7. LDL-C does not cause cardiovascular disease: a comprehensive review of the current literature (LDL-C ne cause pas de maladie cardiovasculaire : une revue complète de la littérature actuelle); Uffe Ravnskov et. al. ; Expert Review of Clinical Pharmacology; October 2018.
8. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel (Les lipoprotéines de basse densité sont à l’origine des maladies cardiovasculaires athéroscléreuses. 1. Preuves issues d’études génétiques, épidémiologiques et cliniques. Une déclaration de consensus du groupe de consensus de la Société européenne d’athérosclérose); Brian A. Ference et al ; National Library of Medicine; août 2017.
Texte original : https://brokenscience.org/research-manipulation-part-ii-surrogate-end-points/